JAMA Cardiology | 顾东风院士团队首次系统描绘中国人群克隆性造血相关体细胞基因突变特征谱
2024.01.14
1月11日,JAMA Cardiology发表了顾东风院士和鲁向锋教授团队的研究,在中国人群中构建了克隆性造血相关的体细胞基因突变特征谱,发现其会显著增加冠心病发生风险,而且与先天炎症基因遗传风险呈现明显叠加效应,对冠心病的早期预测和精准防治具有重大指导价值。

首次系统描绘中国人群克隆性造血相关体细胞基因突变特征谱
遗传因素已被认为在冠心病的发展中起重要作用。近年来,冠心病遗传风险的探索已从生殖细胞遗传突变拓展到体细胞突变。克隆性造血相关体细胞基因突变是指在健康个体中观察到的由于造血干细胞中血液肿瘤相关基因突变导致的外周血细胞克隆扩增现象,由于其对健康的危害和程度不明,因此称这一现象为不确定潜能的克隆性造血(CHIP)。
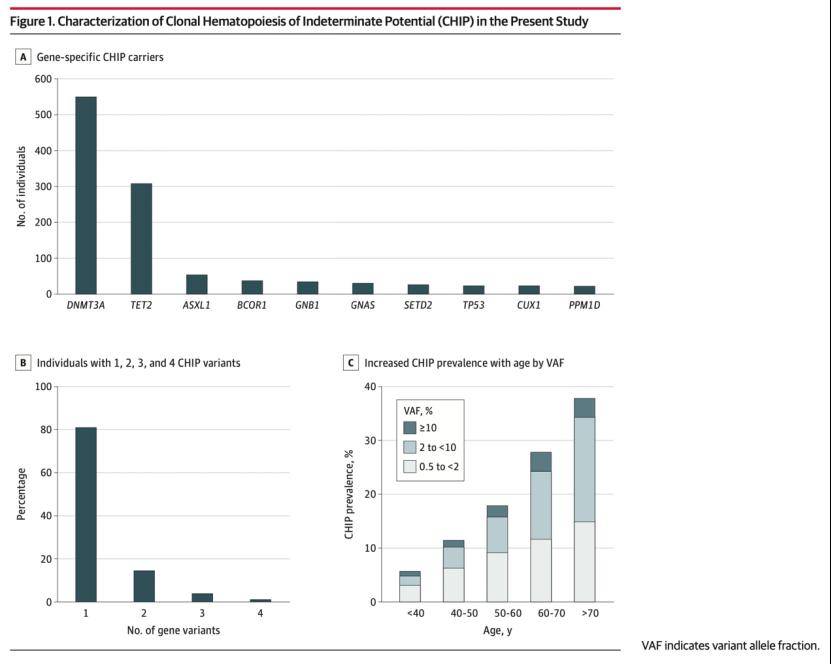
这项研究基于中国随访长达20年6000余例队列人群,通过靶向深度测序系统检测了克隆性造血相关的90个基因以及冠心病相关的500余个基因变异,构建了克隆性造血相关体细胞基因突变(CHIP)特征谱。
研究显示,高达17.8%的个体携带CHIP突变,尤其是观察到人群中携带着既往被忽略的小克隆突变(small mutant clones),相比一般克隆突变携带者呈现明显年轻化趋势。
首次发现小克隆突变对冠心病的影响
由于测序方法深度限制,既往通常将CHIP限定于VAF(Variant allele fraction)≥2%的突变。因此,VAF<2%的小克隆往往被忽视,它是否会影响冠心病的发生完全未知。
该研究基于靶向深度测序方法(深度达916),检测到VAF为1%和0.5%的灵敏度分别为99%和84%,因此可以观察到0.5%≤VAF<2%的小克隆CHIP突变。
研究结果表明,CHIP携带者相较于非携带者发生冠心病的风险将增加42%,且VAF越大,冠心病风险越大,尤其是TET2基因的突变最高可增加近300%的风险。值得注意的是,在年轻人中占比更高的小克隆突变也可增加33%的风险。
首次揭示先天遗传风险对CHIP效应的影响
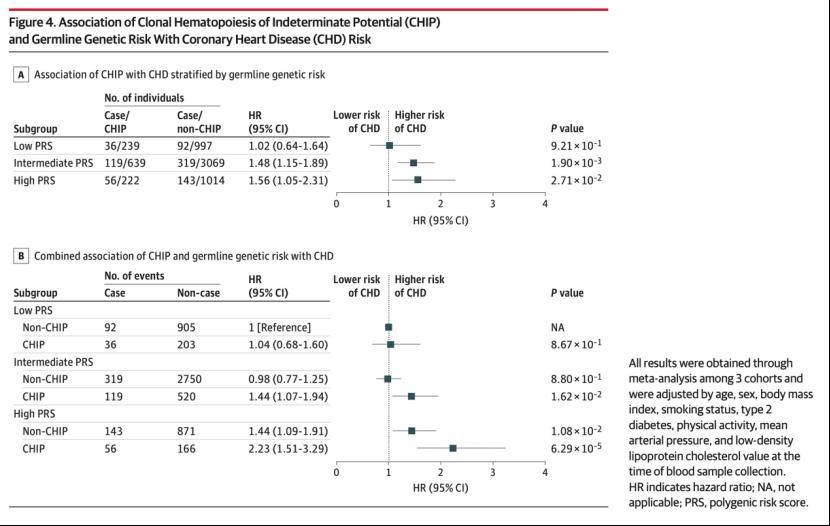
研究人员利用团队既往开发的东亚人群冠心病多基因风险评分(PRS)评估个体冠心病先天遗传易感性,并结合CHIP评估了先天及后天遗传变异对冠心病的协同作用。
研究发现,发现先天遗传高风险人群同时携带后天体细胞突变,冠心病风险将升高120%,而当先天遗传风险较低时,体细胞突变导致的冠心病风险将被完全抵消。
进一步证实发现这一现象主要来自于炎症基因的作用,即当从PRS中去除炎症通路相关变异后,CHIP导致的冠心病风险在不同PRS组间的差异几乎被消除。
作者表示,后天获得的克隆性造血相关体细胞突变主要受到衰老和环境因素的影响,其对心血管疾病的作用尚不完全清楚。
研究系统揭示了后天体细胞突变在中国人群的分布特征,其发生率从30岁开始逐步攀升,提示早期检测对心血管疾病高危人群筛查和早期防控具有重要价值。本研究揭示的先天和后天遗传变异对冠心病联合效应,有望进一步提升心血管疾病高危人群的识别及风险分层能力。
通过全面了解中国人群中CHIP的分布及其与冠心病的关系,该研究为个体化冠心病防控策略的制定提供依据。特别是对于携带小克隆CHIP突变的人群,他们呈现明显年轻化趋势,早期干预可能对阻止克隆扩增、延缓或预防冠心病的发生具有重要的公共卫生学意义。
JAMA Cardiology同期对该研究进行了特邀评论,称该研究填补了CHIP在心血管疾病领域的多个空白,建议通过高深度测序研发相应的遗传风险评估工具,将推动冠心病的个体化精准防治。
