Circulation Research | 顾东风教授团队揭示血管内皮细胞中SWAP70/CAV1核转位促进动脉粥样硬化的作用机制
2026.01.28
冠状动脉粥样硬化性心脏病(冠心病,CAD)是危害人类生命健康的重大心血管疾病。CAD的发病机制涉及遗传因素、传统风险因素(肥胖、吸烟、高血压、高血脂等)、以及环境因素的复杂交互作用。近年来,基于人类全基因组关联分析(GWAS)揭示了大量与CAD关联的遗传位点和致病基因,它们涉及到血管内皮功能障碍、血管重构、脂质代谢、炎症等多种生物学途径。
血管内皮功能障碍与炎症是推动CAD发生、发展的关键病因之一。在人体循环中,异常血流动力学驱动血管内皮损伤和炎症,其机制尚未完全阐明。血管内皮会受到血流剪切应力的作用,主要分为两种:层流剪切应力(LSS,出现在血管直段,稳定单向)和振荡剪切应力(OSS,出现在血管分叉、弯曲、狭窄后等扰流区,方向反复逆转、双向振荡)。与LSS相比,OSS更容易破坏血管内皮功能,导致炎症和动脉粥样硬化(AS)。虽然OSS在不同年龄段的人群中普遍存在,但并非每个人都会发展成AS。这取决于个体的遗传背景和风险因素。例如,携带特定遗传风险等位基因的人群,对于OSS触发的血管内皮炎症反应更具易感性。此外,高血压增强血管壁的机械应力和局部血流扰动,可进一步放大OSS的负面效应,从而加速AS的发生与进展。
开关相关蛋白70(Switch-associated protein 70, SWAP70)基因位于人类11号染色体短臂上(Chr11p15.4)。前期,国外同行及顾东风教授团队研究均发现: SWAP70基因座内的风险等位基因(包括 rs10840293,核苷酸G/A突变)与人群CAD 风险密切相关。SWAP70是具有核—胞质穿梭能力的信号衔接蛋白。小窝蛋白-1(CAV1)响应OSS,并在血管内皮炎症中发挥作用。此项研究探讨了OSS条件下SWAP70/CAV1参与血管内皮炎症反应及AS的作用机制。
2026年1月14日,南方科技大学顾东风教授团队在Circulation Research杂志上发表题为 “SWAP70 Promotes Atherosclerosis Via Endothelial CAV1 Nuclear Translocation” 的研究论文,揭示了异常血流动力学条件下SWAP70/CAV1核转位促进血管内皮炎症及AS发生的潜在机制。

研究团队首先从GTEx数据库提取了eQTL数据。结果显示:在人主动脉组织中,CAD风险等位基因与SWAP70表达增加呈正相关。CAD患者血管斑块的单细胞转录组测序结果证实:与非症状性患者相比,有症状性患者血管内皮细胞中 SWAP70 表达显著升高。此外,SWAP70在小鼠主动脉内皮细胞中特异性表达。与暴露于LSS的胸主动脉相比,易受OSS影响的主动脉弓部位 SWAP70 的基因及蛋白表达显著上调。进一步研究发现:在人脐静脉内皮细胞(HUVECs)中,OSS显著升高SWAP70 表达,其基因启动区的染色质可及性增强,提示紊乱血流条件刺激 SWAP70 转录激活(图 1)。
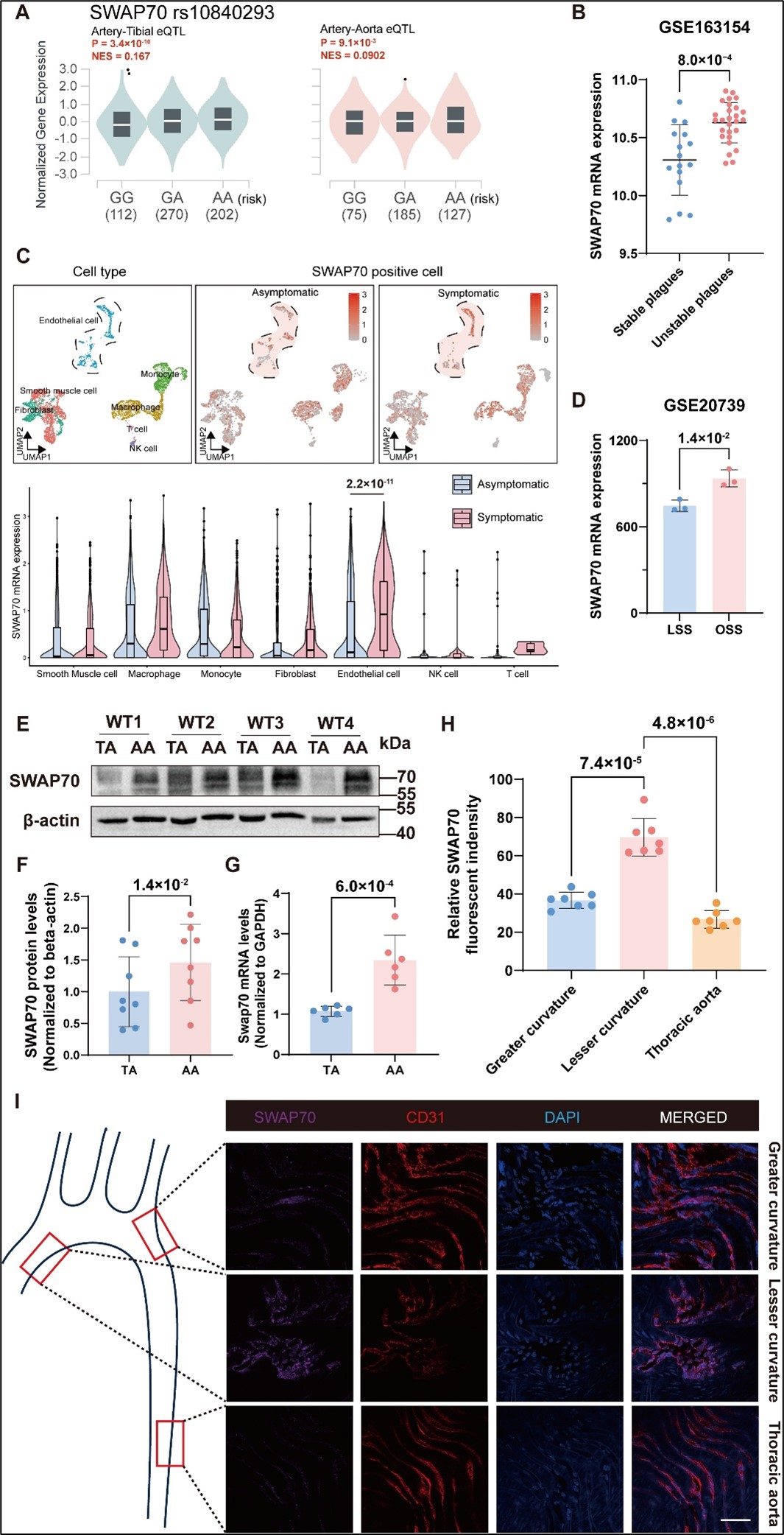
图1. SWAP70在动脉粥样硬化斑块的血管内皮细胞中表达上调
研究团队进一步探讨了 SWAP70 调控血管内皮炎症的作用机制。在HUVECs和人冠状动脉内皮细胞(HCAECs)中,敲低 SWAP70 显著降低TNFα、IL-6 或 LPS 诱导的炎症反应。相反,SWAP70 过表达显著增强VCAM1、CXCL8 等炎症因子的表达。转录组测序显示SWAP70 调控多条与血管内皮功能相关的信号通路,包括 TNFα 信号、细胞周期、细胞衰老、自噬等通路(图 2)。
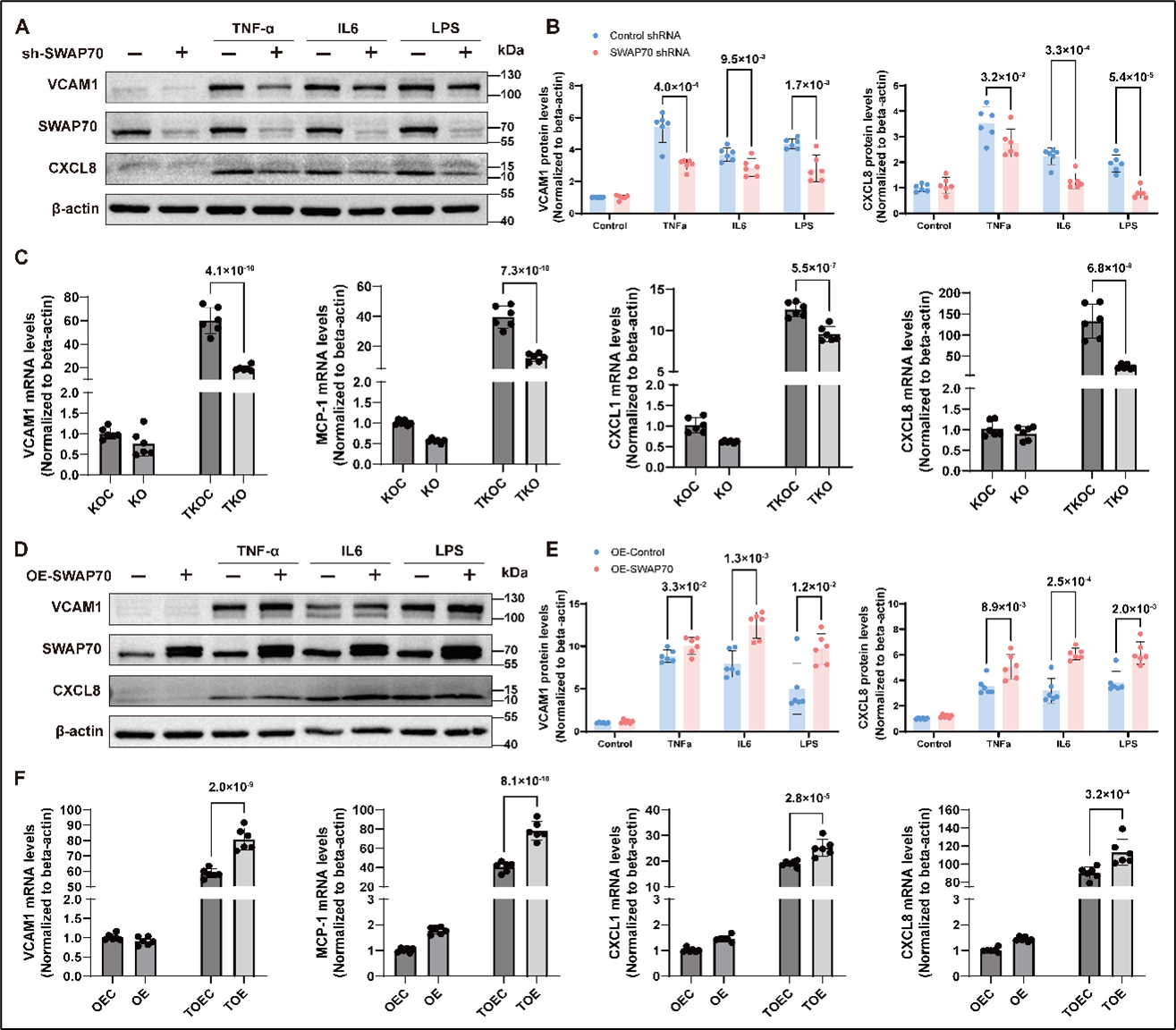
图2. SWAP70促进血管内皮细胞炎症反应
研究团队通过免疫共沉淀结合质谱(IP–MS)分析证实: 在血管内皮中,SWAP70 与 CAV1 支架结构域之间存在相互作用。OSS显著促进CAV1向细胞核转位。敲低 SWAP70 减少 OSS 条件下 CAV1 细胞核转位(图 3)。为进一步解析SWAP70/CAV1互作及其在细胞内定位,研究团队采用邻近连接技术(PLA)对蛋白互作进行了原位可视化检测。PLA 结果显示,在炎症因子刺激及OSS条件下,SWAP70/CAV1复合物向细胞核转位,其进一步结合 VCAM1 启动子增强其转录活性。抑制SWAP70/CAV1互作可减少CAV1核转位,降低血管内皮细胞炎症反应(图 4)。
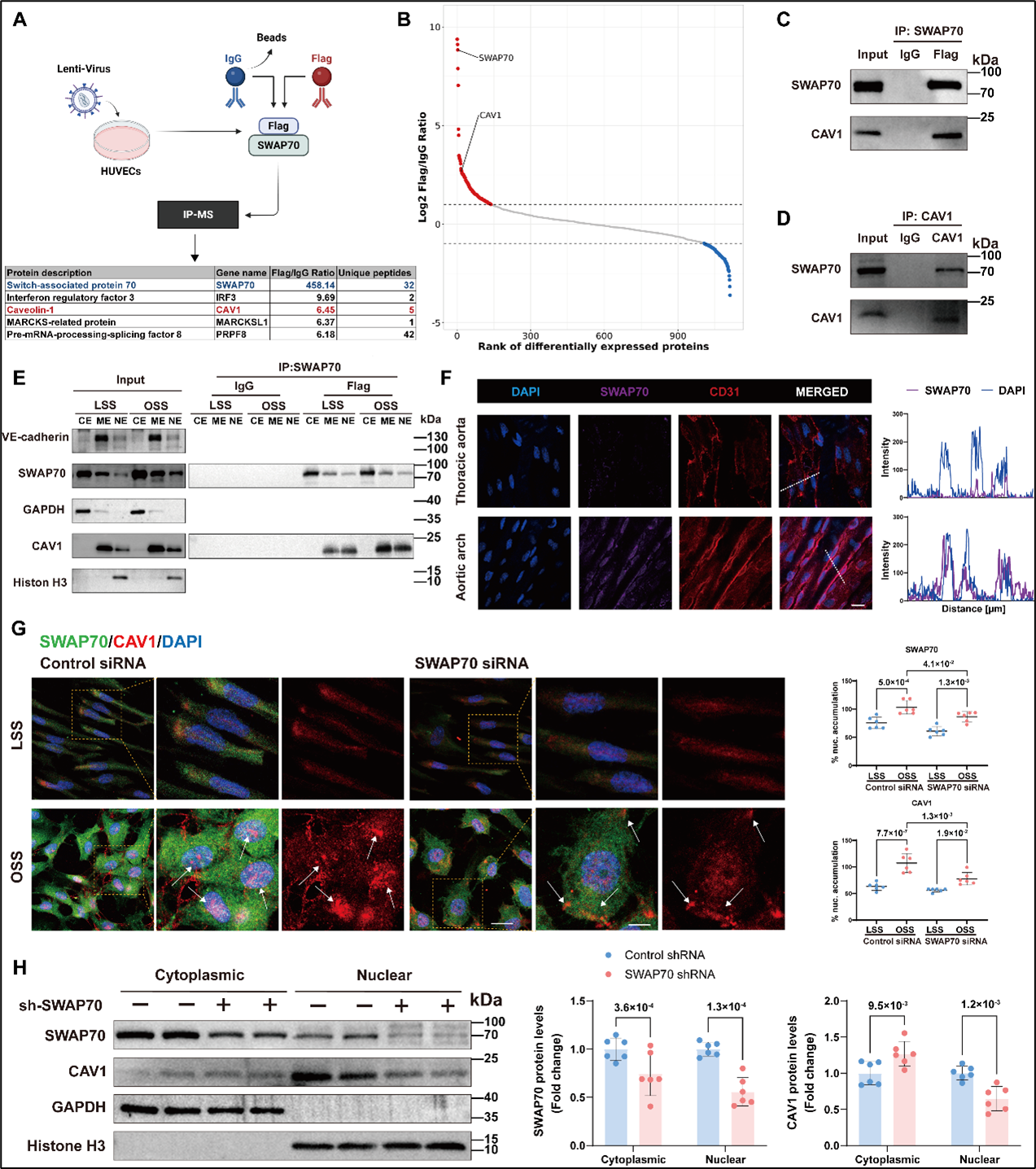
图3. SWAP70与CAV1互作并介导CAV1核转位
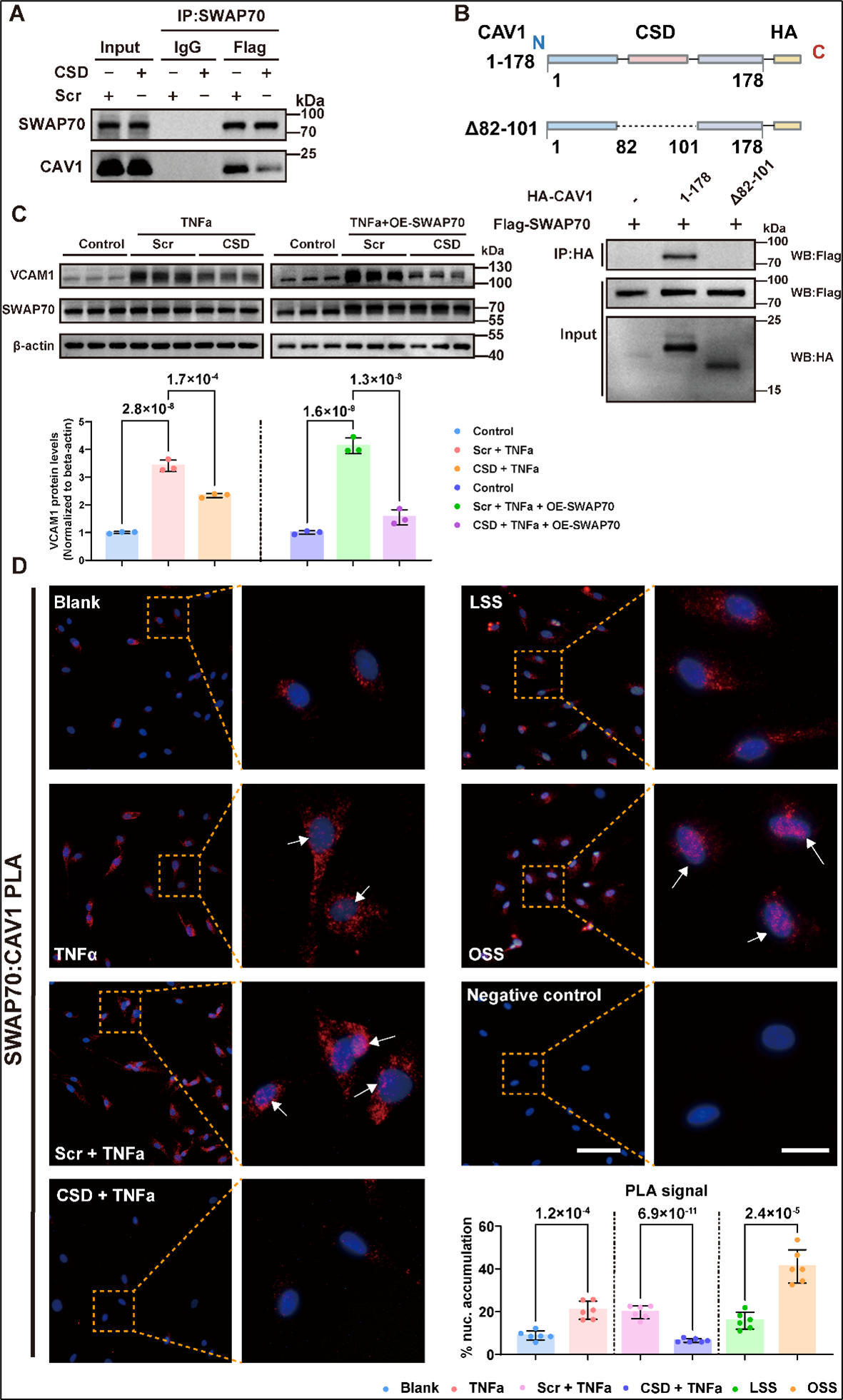
图4. 炎症因子及OSS促进SWAP70/CAV1核转位
最后,研究团队分别构建了血管内皮细胞SWAP70特异性敲除和过表达小鼠模型。结果表明:敲除 SWAP70 减轻AS斑块形成,增加斑块胶原沉积,减少坏死核心及巨噬细胞浸润,提示其改善了斑块稳定性(图5)。相反,SWAP70 过表达则加重小鼠AS的程度并降低斑块稳定性。
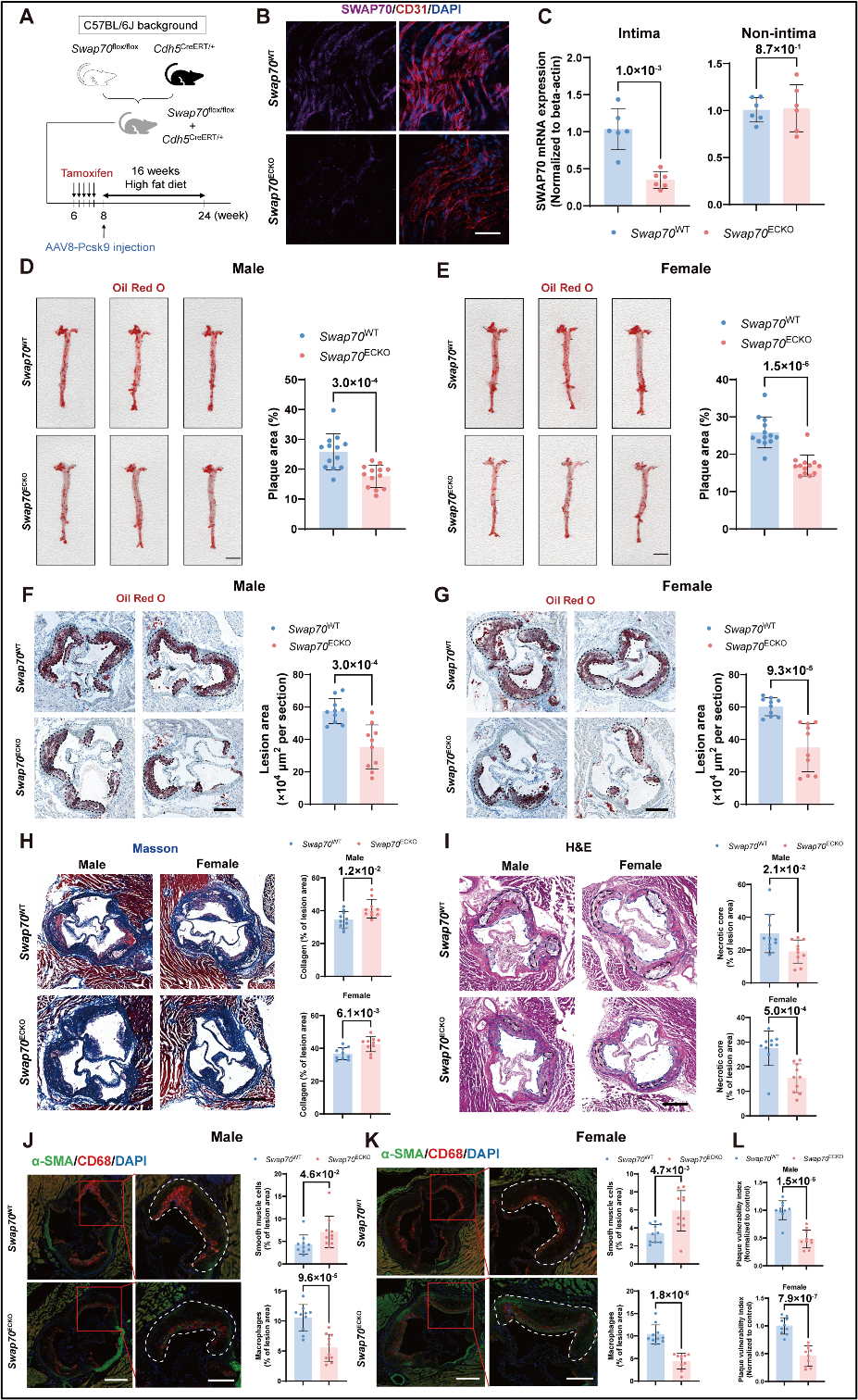
图5. 血管内皮特异性敲除SWAP70延缓动脉粥样硬化并提高斑块稳定性
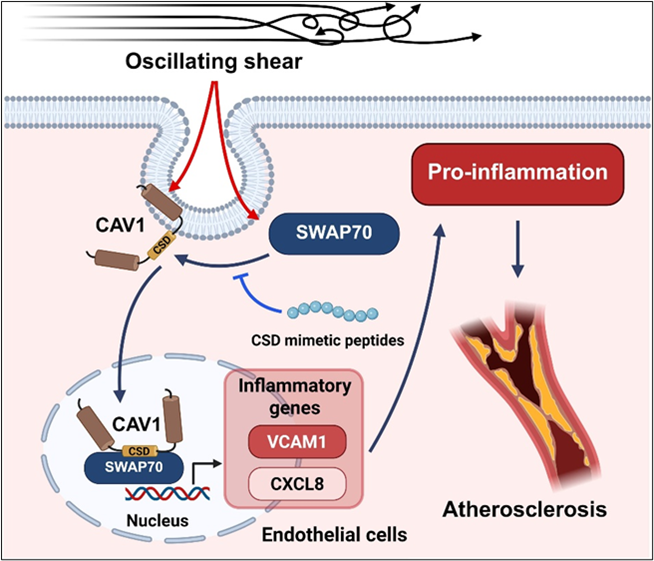
综上所述,人群队列研究提示 SWAP70 为CAD的遗传易感基因,其风险等位基因增加CAD 发病风险。该研究揭示:在OSS或炎症条件下,SWAP70与CAV1形成复合物,通过核转位增强炎症基因表达,从而驱动内皮炎症和AS发生(摘要图)。研究结果提示:遗传风险、高血压等因素可增强OSS的不良效应,从而增加特定人群发生AS的易感性。通过基因筛查识别携带rs10840293等风险基因的个体并进行个性化干预,如加强血压、血脂控制,改善生活方式(如戒烟、运动),药物(如他汀类)保护血管内皮功能等,有助于减少人群AS负担。本研究为GWAS风险位点提供了机制验证,对心血管疾病的精准预防提供了实验证据。
南方科技大学公共卫生及应急管理学院顾东风教授、白波副研究员为该论文的通讯作者。南方科技大学高天宇博士研究生为该论文第一作者。该研究工作得到了国家自然科学基金、广东省基础与应用基础研究基金等项目资助。同时衷心感谢中山大学附属第八医院伍贵富教授,邓林研究员提供IBIDI流体剪切力系统用于本项研究。
原文链接:https://doi.org/10.1161/CIRCRESAHA.125.327048
